Hoy día se conocen cientos de elementos los cuales caracterizan la tabla periódica, pero es necesario lograr una interrelación entre los elementos de la misma junto con cosas, objetos, materiales que se conocen en la cotidianidad, sólo así se logra el aprendizaje significativo en los educandos. Este recurso servirá para el conocimiento de la estructura de la tabla periódica.
La tabla periódica fue hecha para clasificar y dividir los elementos químicos, partiendo de sus propiedades y características, básicamente su función es establecer un orden a partir de la clasificación de los elementos. La versión actual que se conoce de la tabla periódica fue hecha por Alfred Warner un químico de origen suizo, que modifico la tabla original elaborada por el químico de origen ruso, Dmitri Mendeléyev a quien se le atribuye la creación de la tabla de los elementos.
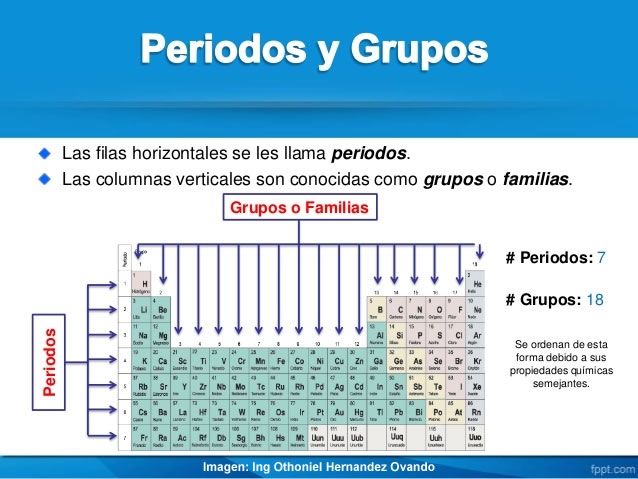
Grupos de la tabla periódica.
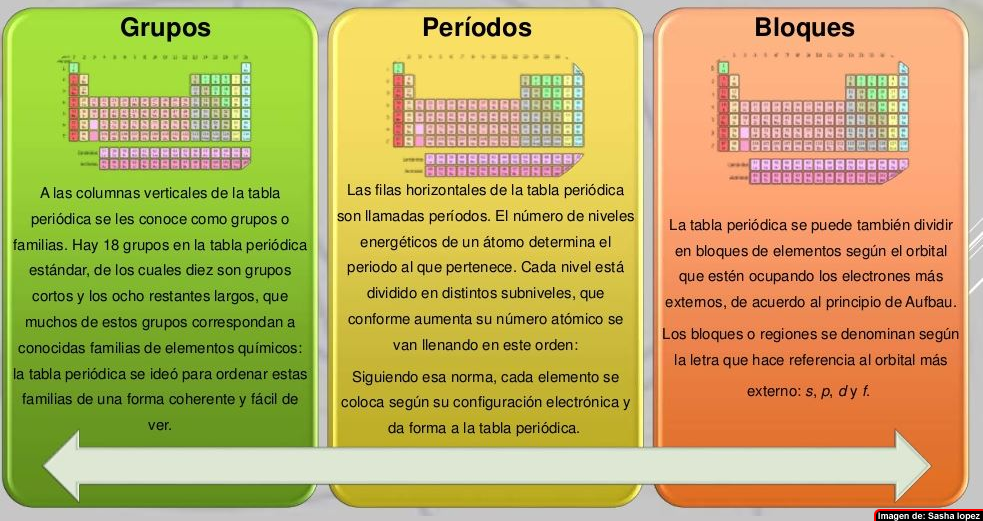
A las columnas verticales de la tabla periódica se les conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, y por ello, tienen características o propiedades similares entre sí. Por ejemplo, los elementos en el grupo IA tienen valencia de 1 (un electrón en su último nivel de energía) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son todos extremadamente no reactivos.
La tabla periódica está compuesta por 118 elementos.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988[2] , los grupos de la tabla periódica son:
Grupo 1 (I A): los metales alcalinos
Grupo 2 (II A): los metales alcalinotérreos
Grupo 13 (III A): Los térreos
Grupo 14 (IV A): Los carbonoideos
Grupo 15 (V A): Los nitrogenoideos
Grupo 16 (VI A): Los calcógenos o anfígenos
Grupo 17 (VII A): Los halógenos
Grupo 18 (VIII A): Los gases nobles
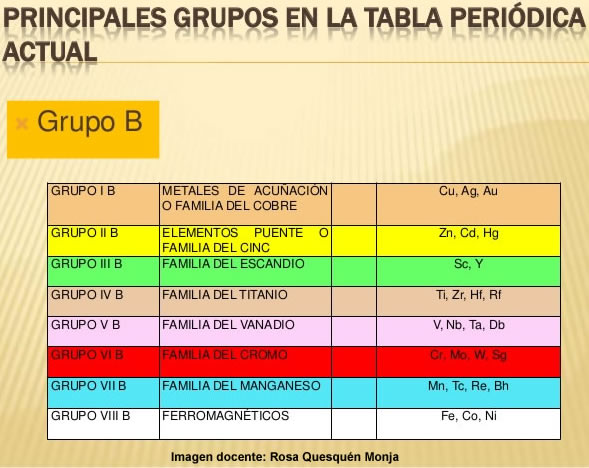
Grupo 3 (III B): Familia del Escandio
Grupo 4 (IV B): Familia del Titanio
Grupo 5 (V B): Familia del Vanadio
Grupo 6 (VI B): Familia del Cromo
Grupo 7 (VII B): Familia del Manganeso
Grupo 8 (VIII B): Familia del Hierro
Grupo 9 (VIII B): Familia del Cobalto
Grupo 10 (VIII B): Familia del Níquel
Grupo 11 (I B): Familia del Cobre
Grupo 12 (II B): Familia del Zinc
Lantánidos y actínidos: Tierras raras.
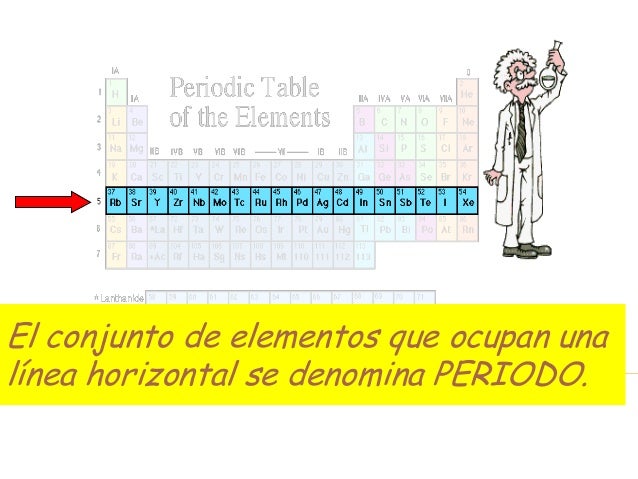
Períodos de la tabla periódica
Las filas horizontales de la tabla periódica son llamadas períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. El primer período solo tiene dos miembros: hidrógeno y helio; ambos tienen sólo el orbital 1s.
La tabla periódica consta de 7 períodos:
 Período 1: Consta de 2 elementos.
Período 1: Consta de 2 elementos.
Período 2: Consta de 8 elementos.
Período 3: Consta de 8 elementos.
Período 4: Consta de 18 elementos.
Período 5: Consta de 18 elementos.
Período 6: Consta de 32 elementos.
Período 7: Consta de 32 elementos.
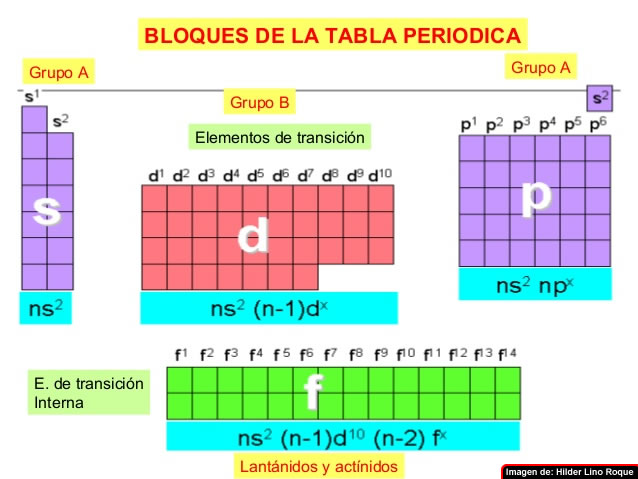
Bloques de la tabla periódica
La tabla también está dividida en cuatro bloques, s, p, d, f, que están ubicados en el orden sdp, de izquierda a derecha, y f lantánidos y actínidos. Esto depende de la letra en terminación de los elementos de este grupo, según el principio de Aufbau.
Te presentamos esta ilustración, que resume todo lo que aprendiste anteriormente sobre los grupos, períodos y bloques de la tabla periódica.
El siguiente video te los sugerimos, para que de forma amena, refuerces los conocimientos adquiridos sobre la tabla periódica.
Te dejamos aquí la tabla periódica interactiva, donde podrás ver todos los contenidos sobre sus elementos, la cual te ofrece un enlace directo a la Wikipedia, Haz clic aquí
Te recomendamos que realices los siguientes ejercicios de la Tabla Periódica, para que practiques lo que has aprendido.
Elementos relacionados
Fuentes
- Cienciaaldia2011.webnode.es Periodo/lecturas/grupos-periodos-bloques-de-la-tabla-periodica
- http://www.areaciencias.com/