El siguiente texto contiene información sobre: qué es la electroquímica, los procesos que ocurren en las celdas electrolíticas y galvánicas y sus diferencias y las reacciones redox, Esperamos que te sirva de apoyo en clases, cuando impartas este tema.

El siguiente mapa conceptual es un resumen de las reacciones de oxidación-reducción (redox), con el mismo podrás explicar en clases, en qué consisten estas reacciones.
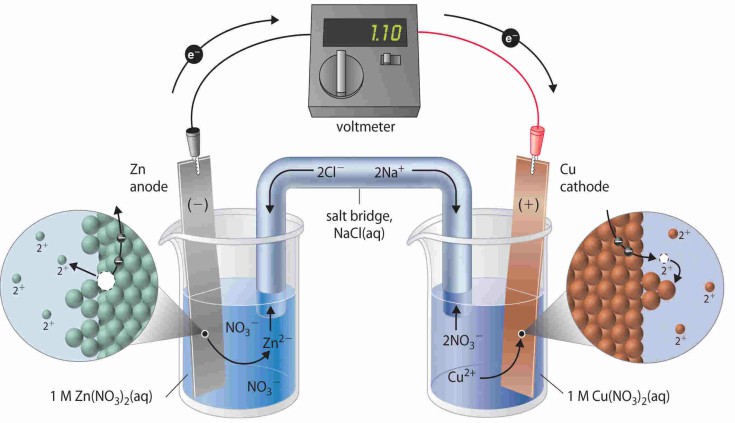
La corriente eléctrica representa transferencia de carga. La carga puede conducirse a través de electrolitos que son sustancias que permiten la conducción eléctrica a través de iones en movimiento, son principalmente compuestos iónicos fundidos o disueltos en agua. Los electrolitos al contacto con los electrodos en una celda provocan la conductividad eléctrica. Los electrodos son superficies sobre las cuales se producen semirreacciones de oxidación-reducción.
Tanto en la celda electrolítica como voltaica, el cátodo se define como el electrodo donde se produce la reducción y el ánodo se define como el electrodo sobre el que se produce la oxidación.
El campo de la electroquímica ha sido dividido en dos grandes secciones. La primera de ellas es la electrolisis, la cual se refiere a las reacciones químicas que se producen por acción de una corriente eléctrica. La otra sección se refiere a aquellas reacciones químicas que generan una corriente eléctrica, éste proceso se lleva a cabo en una celda o pila galvánica.
Hay dos tipos fundamentales de celdas y en ambas tiene lugar una reacción redox, y la conversión o transformación de un tipo de energía en otra:
- La celda galvánica o celda voltaica transforma una reacción química espontánea en una corriente eléctrica, la cual sale a un circuito externo.Un ejemplo común de celda electroquímica es la«pila» estándar de 1,5 voltios. Una «pila» es una celda galvánica simple, mientras una batería consta de varias celdas conectadas en serie.
- La celda electrolítica o cuba electrolítica, transforma una corriente eléctrica en una reacción química de oxidación-reducción que no tiene lugar de modo espontáneo. En muchas de estas reacciones se descompone una sustancia química por lo que dicho proceso recibe el nombre de electrolisis, como ejemplo tenemos la electrolisis del agua. A diferencia de la celda voltaica, en la celda electrolítica, los dos electrodos no necesitan estar separados, por lo que hay un sólo recipiente en el que tienen lugar las dos semirreacciones.
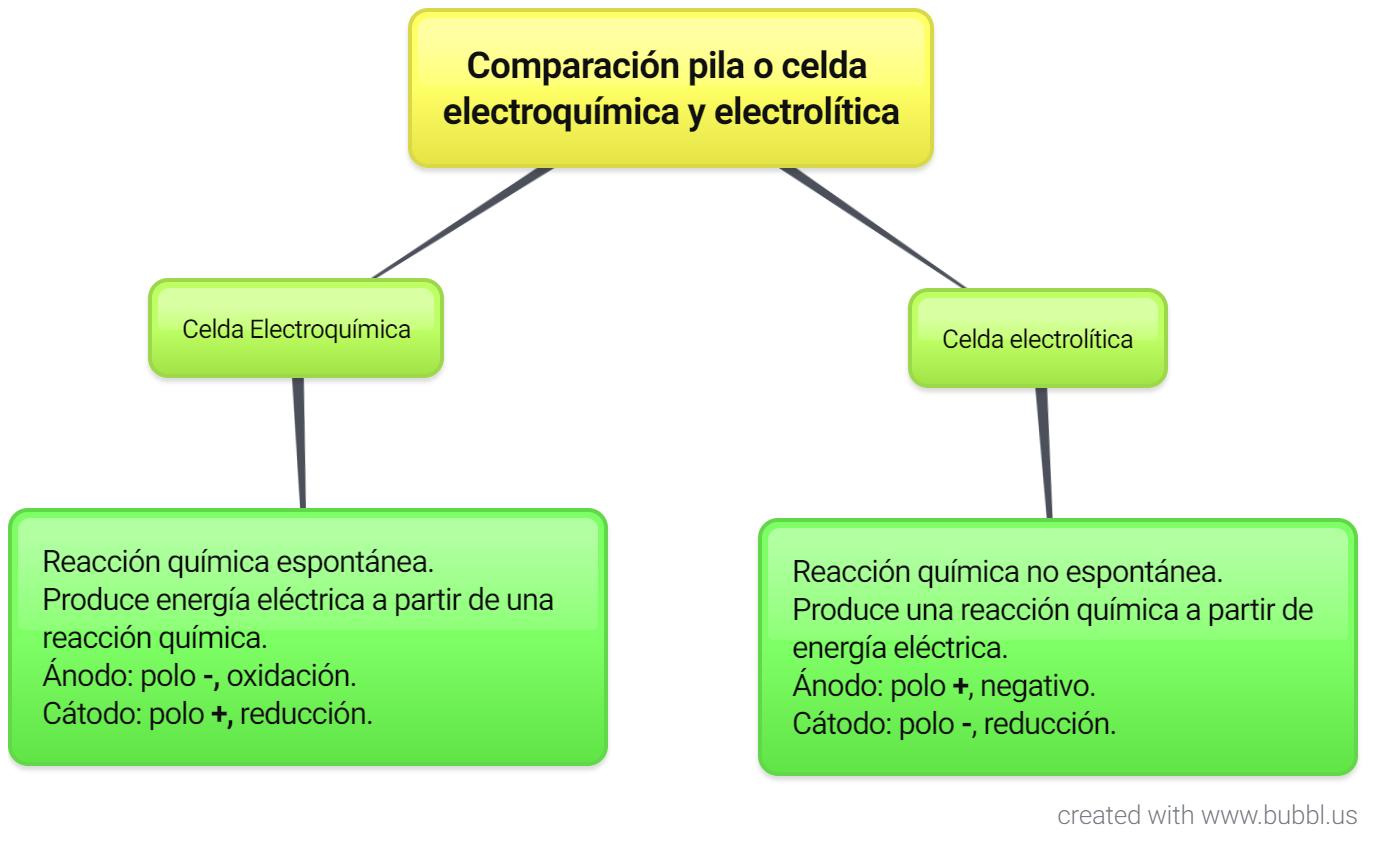
Después de explicado en qué consisten las celdas galvánicas o electroquímicas y las celdas electrolíticas, con este cuadro los estudiantes podrán tener una mejor comprensión de cuáles son las diferencias entre ambas.
En este video, los estudiantes podrán ver un experimento donde se llevará a cabo la electrolisis de una servilleta y tiene como objetivo observar la electrolisis del agua.