Este recurso te lo sugerimos, para que lo utilices en clases cuando impartas el tema sobre las reacciones químicas y sus tipos.
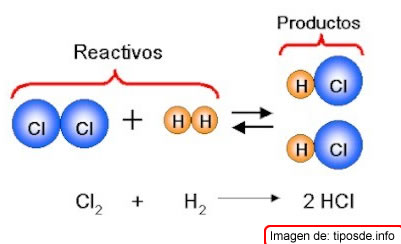
Los reactivos pueden ser elementos o compuestos. Un ejemplo de reacción química es cuando una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio y al reaccionar el cloro y el hidrógeno se forma el ácido clorhídrico, esta reacción es la que se muestra a continuación.
A la representación simbólica de las reacciones se les denomina ecuaciones químicas.
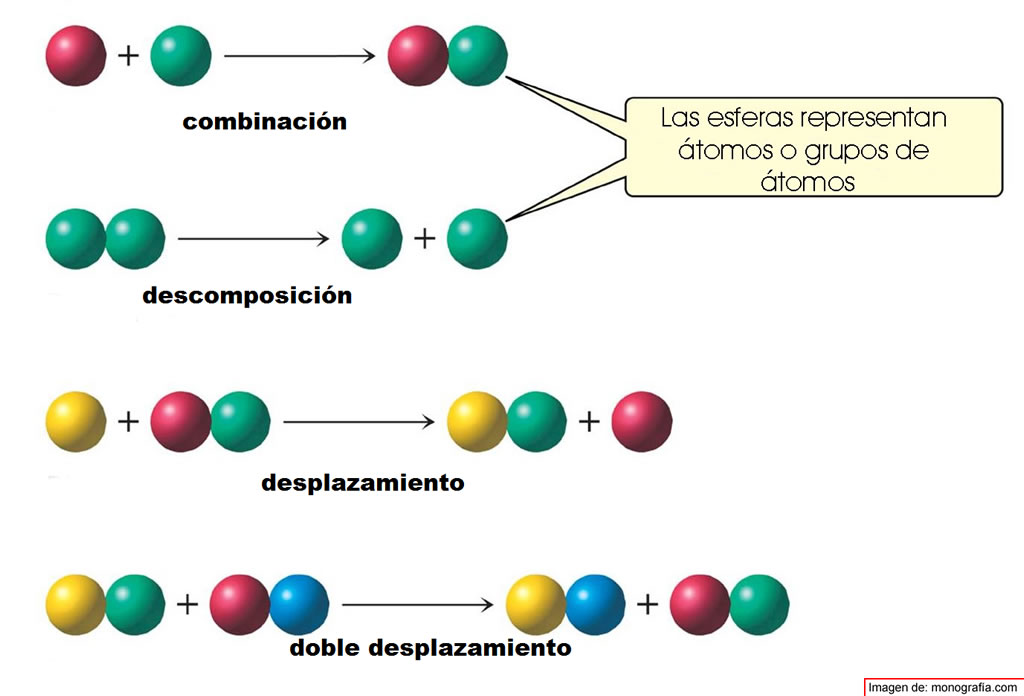
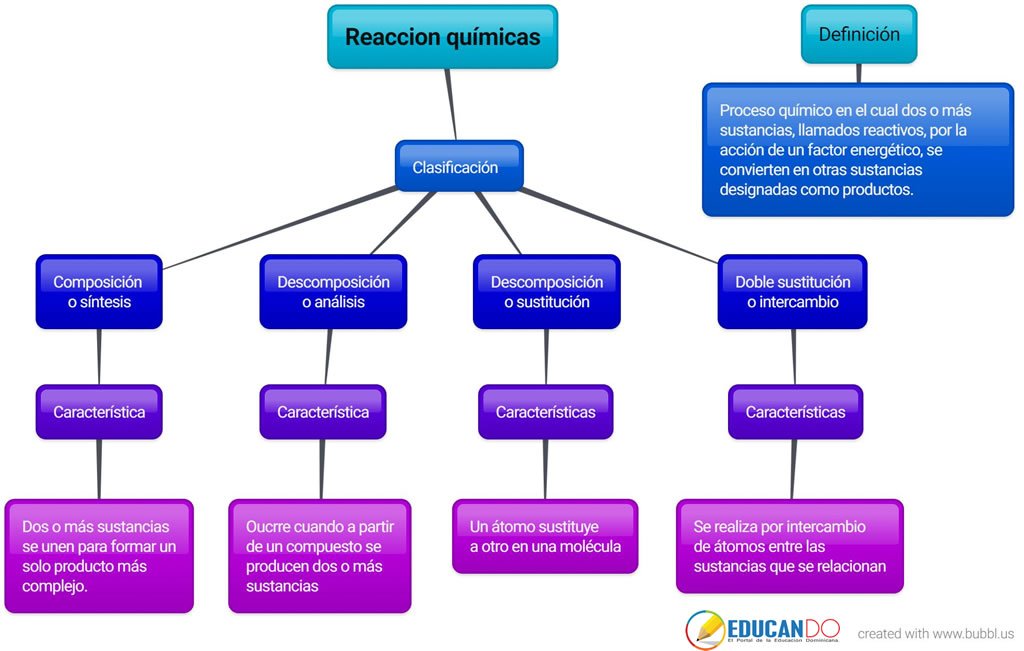
Desde el punto de vista estructural las reacciones químicas se clasifican en: síntesis o combinación, descomposición, desplazamiento, doble desplazamiento.
También existen otras reacciones como son: neutralización, oxidación y redox.
Reacciones de síntesis o combinación
Cuando reaccionan dos reactivos para formar un solo producto. Ejemplos: cuando el sodio (Na) se combina con el cloro (Cl) se forma el cloruro de sodio (NaCl), la oxidación de los metales y otros.
Reacciones de descomposición
Una sustancia se descompone en otras más simples. Ejemplos: cuando el dióxido de carbono (CO2) se descompone en (C) y (O2)
Reacciones de desplazamiento
Es la reacción de un elemento químico con un compuesto donde el elemento desplaza a otro elemento que forma parte del compuesto.
Reacciones de doble desplazamiento
Es la reacción entre dos compuestos donde existe un intercambio de elementos y se producen dos nuevos compuestos.
Para mostrar las reacciones químicas se han utilizado esferas, estas representan átomos o grupos de átomos, puedes utilizar los siguientes esquemas para una mejor comprensión de los estudiantes, de las siguientes ecuaciones químicas.
Reacciones de oxidación
Cuando a un compuesto se le agrega oxígeno y libera óxido y agua. Ejemplo: es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural.
Reacciones de neutralización (ácidos- bases)
Cuando una sustancia ácida reacciona con una sustancia básica o alcalina y se obtiene una sal.




Excelente material…